Résultats du cycle annuel EMERGINCaRE en 2024
Mis à jour le
Le dispositif d'horizon scanning apporte un éclairage complémentaire aux analyses et décisions portées par les acteurs du secteur de la santé en charge de l'accès aux médicaments, sur l'offre dense des développements en oncologie dans un objectif de partage et de choix collectif afin d'optimiser l'accès au niveau national aux traitements qui pourraient apporter des améliorations dans les stratégies thérapeutiques de certains cancers au bénéfice des patients. Il ne s'agit en aucun cas d'une pré-évaluation de ces produits en amont des étapes classiques d'accès au marché de droit commun ou dérogatoire.
Les informations permettant la réalisation des cycles d'horizon scanning sont publiques et mises en perspective par les commentaires des professionnels de santé qui font le soin et la recherche au quotidien.
Lors du cycle 2024 d’Horizon scanning, 69 développements ont été analysés par l’Institut et les parties intéressées. Parmi ces développements, 64% concernent des indications en oncologie solide et 36% concernent des indications en onco-hématologie.
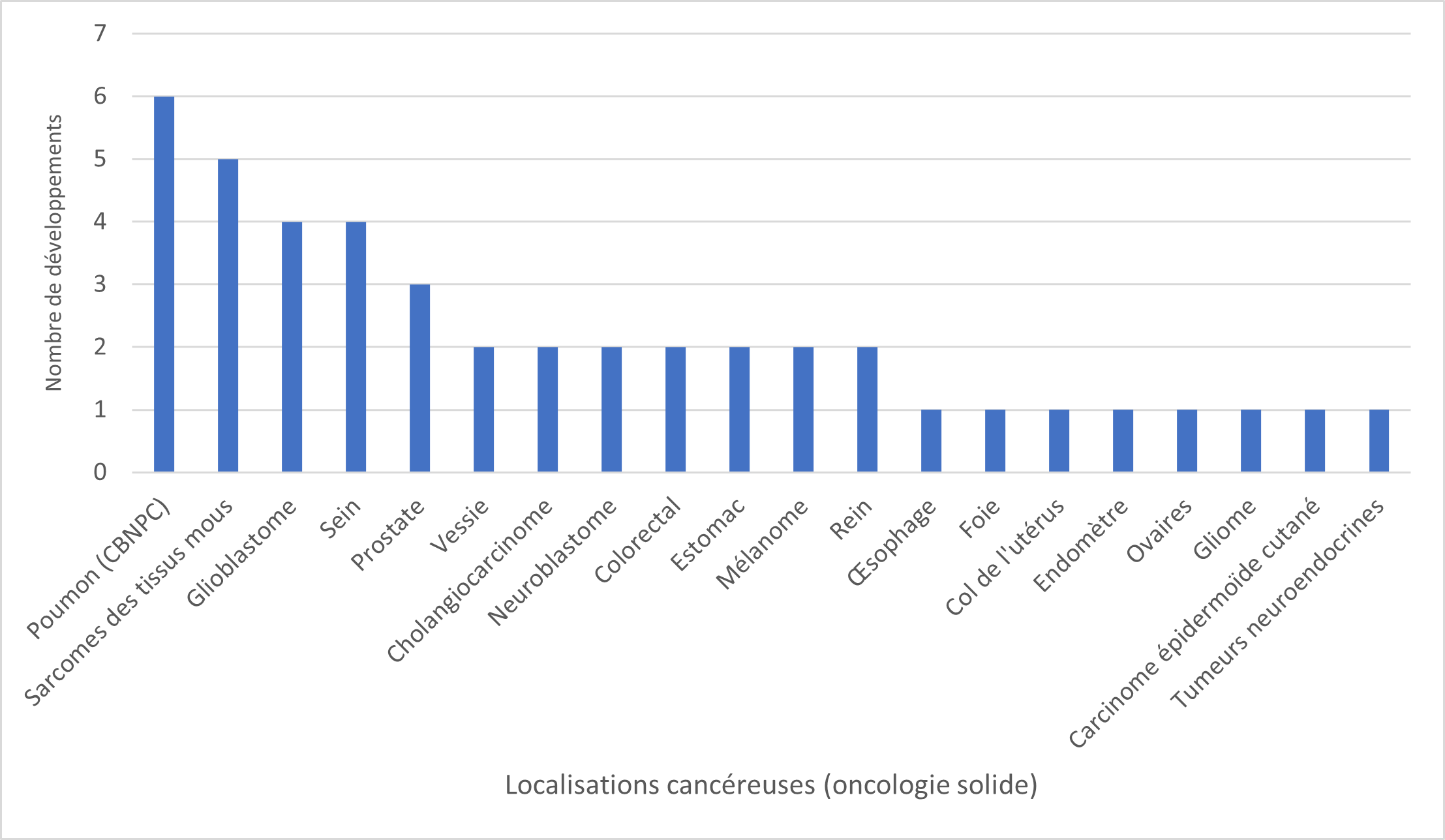
Les 5 localisations cancéreuses les plus représentées parmi ces développements sont les :
- Cancers bronchiques non à petites cellules (n=6)
- Sarcomes des tissus mous (n=5)
- Cancers du sein (RH+ ou triple négatif) (n=4)
- Glioblastomes (n=4)
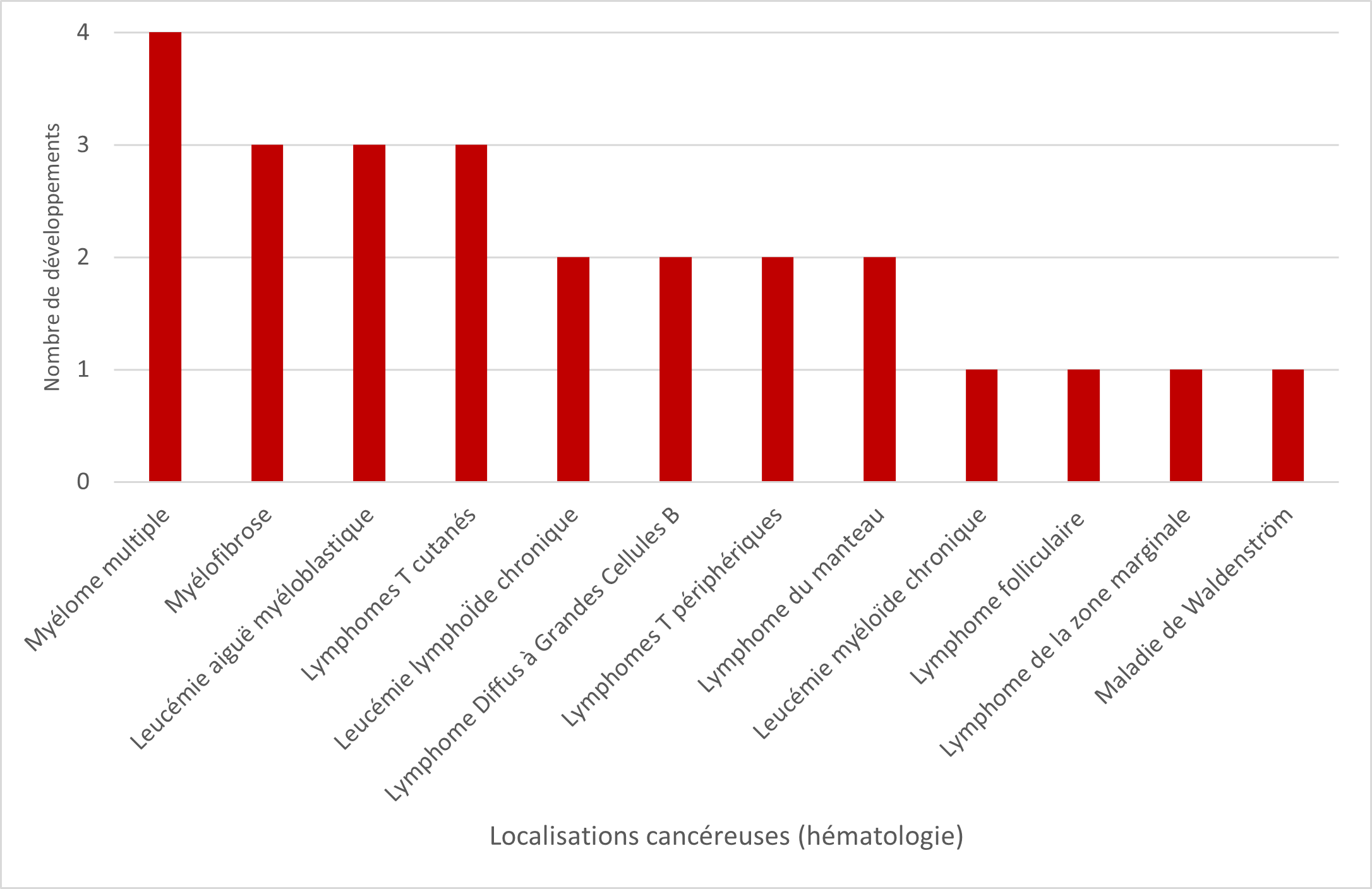
- Myélomes multiples (n=4)
Les autres localisations sont rapportées dans les figures 1 et 2 ci-dessous :
Pédiatrie : Sur l’ensemble des développements analysés, 5 développements évaluent un médicament chez les patients pédiatriques dans les gliomes, les neuroblastomes ou les sarcomes des tissus mous.
Médicaments de Thérapie Innovante (MTI) : Sur l’ensemble des développements analysés, 6 développements évaluent un MTI.
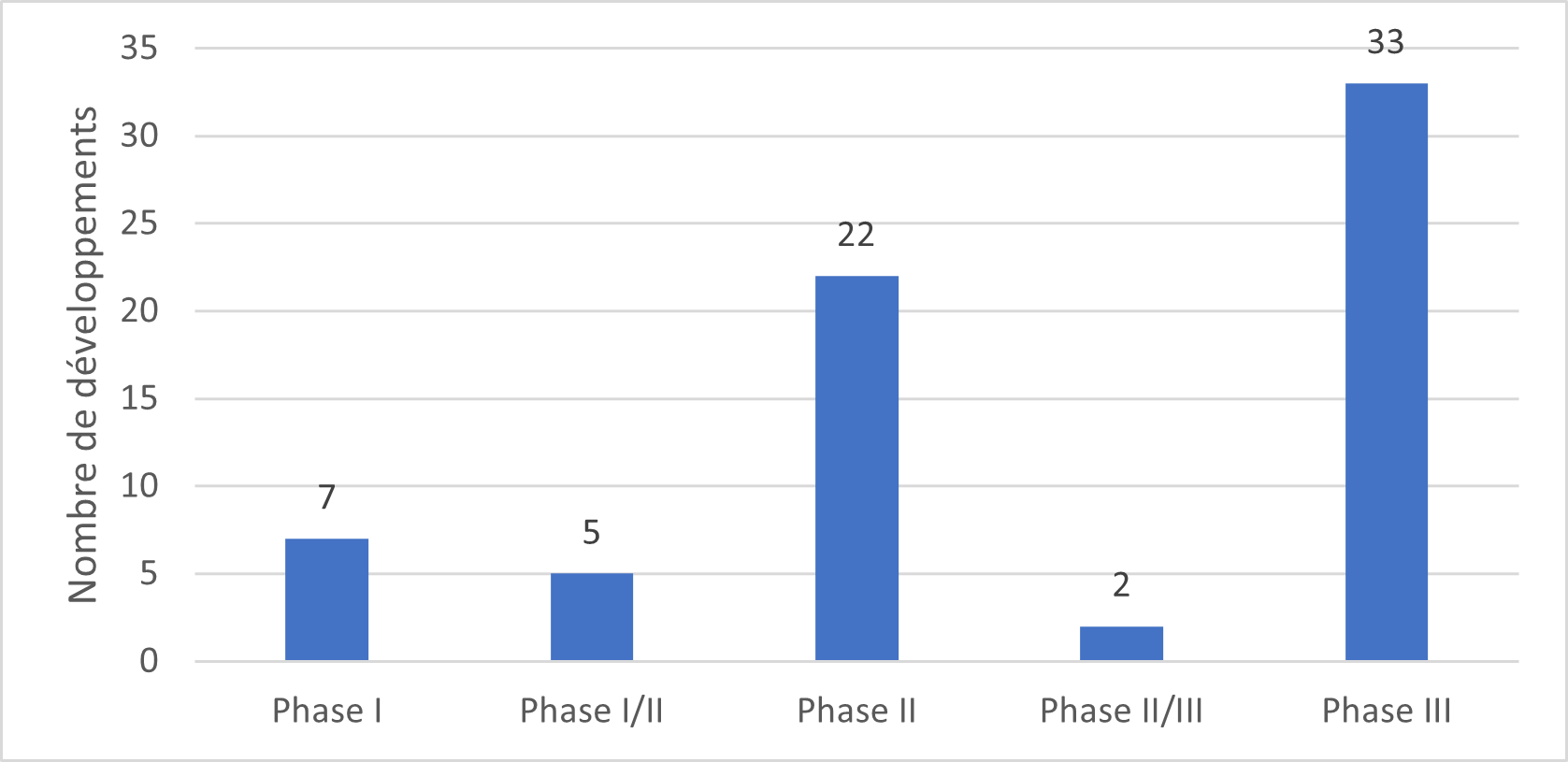
Phases d’essai clinique : La majorité des développements analysés concerne des essais cliniques de phase III comme présenté dans la figure 3 ci-dessous :
Parmi les 69 développements analysés lors de ce cycle et au regard des scores attribués à chaque développement et des commentaires des cliniciens l’Institut et le Comité de pilotage national (COPIL) ont décidé de prioriser les 6 développements suivants :
- la thérapie cellulaire letetresgene autoleucel, en 3e ligne dans le traitement des sarcomes des tissus mous (1 développement dans le sarcome synovial et 1 développement dans le liposarcome myxoïde à cellules rondes)
- la thérapie génique cretostimogene grenadenorepvec, en 2e ligne dans le traitement des cancers invasifs de la vessie n’infiltrant pas le muscle et non répondeur au Bacillus-Calmette-Guérin (BCG)
- le vaccin à ARNm-4157, associé au pembrolizumab, en traitement adjuvant après une résection complète d’un mélanome à haut risque
- l’immunothérapie durvalumab, associé à la chimiothérapie FLOT (acide folinique, oxaliplatine, fluorouracile, docétaxel) en traitement néoadjuvant suivi par le durvalumab monothérapie en adjuvant dans les cancers gastriques ou de la jonction œsogastrique résécable
- la thérapie ciblée taletrectinib, en 2ème ligne dans le traitement des cancers bronchiques non à petites cellules avancés ou métastatiques ROS1+