Biomarqueurs et tests moléculaires
Mis à jour le
Un biomarqueur est une caractéristique de notre corps pouvant être mesurée, tel qu'un gène, une molécule ou encore un paramètre sanguin. Dans le cadre de la médecine de précision, le test moléculaire permet de mesurer ces biomarqueurs pour identifier des anomalies spécifiques et proposer au patient un traitement adapté à son cancer et à ses anomalies.
Qu'est-ce qu'un test moléculaire ?
La prescription de certains traitements de médecine de précision est conditionnée par la présence d’anomalies moléculaires spécifiques. Seuls les patients présentant une anomalie moléculaire donnée dans leur tumeur, identifiée par un test moléculaire, se verront prescrire le traitement correspondant.
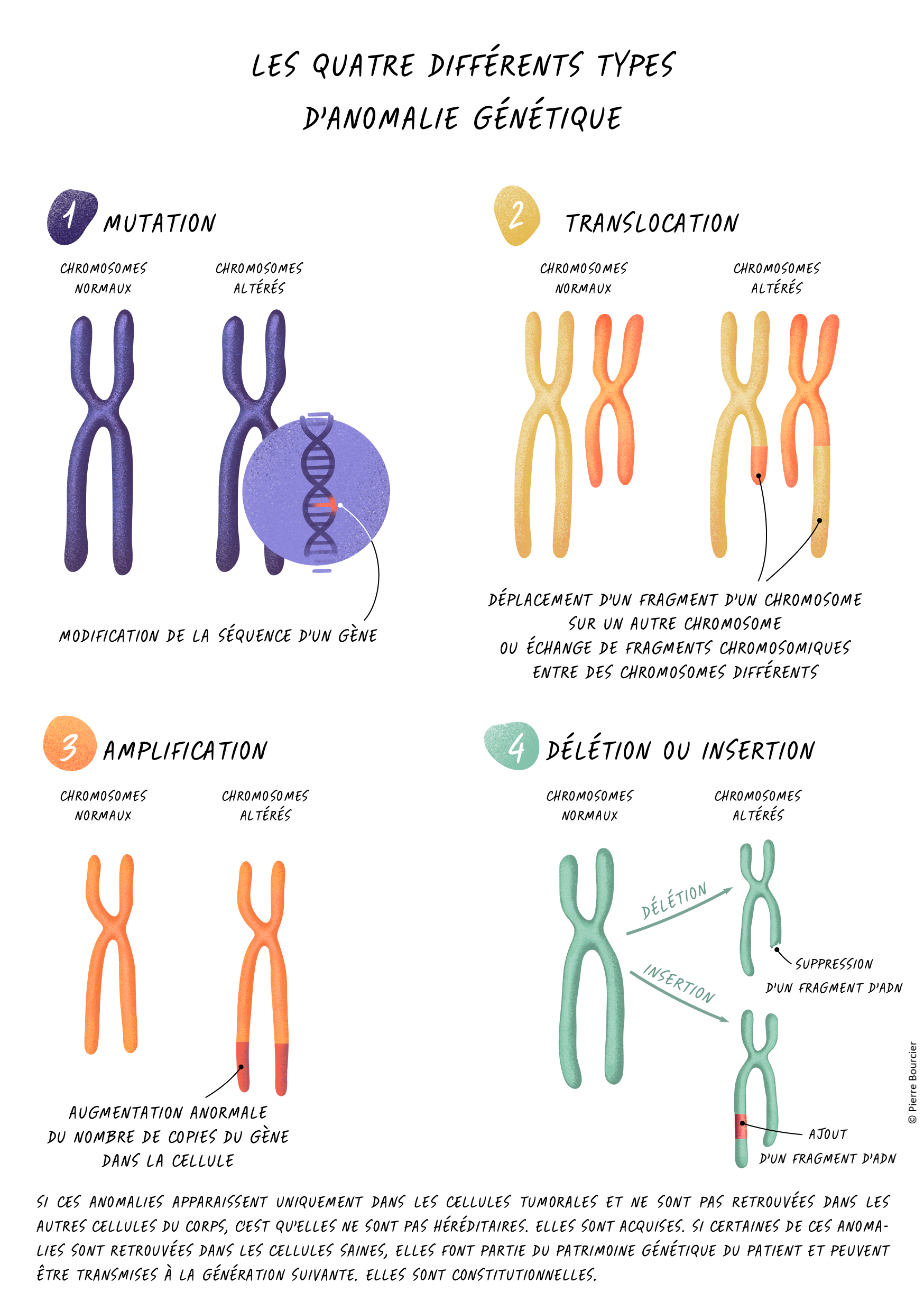
Un test moléculaire vise à détecter d’éventuelles anomalies ou altérations moléculaires dans la tumeur d’un patient. Ces anomalies peuvent se présenter sous la forme de quatre différents types d'anomalie génétique : la mutation, la translocation, l'amplification et la délétion ou l'insertion des chromosomes.
Comment se déroule un test moléculaire ?
Les tests moléculaires sont réalisés à partir d’un prélèvement de la tumeur. Ils peuvent être prescrits par un oncologue, un spécialiste d’organe ou un pathologiste.
Cette demande d’examen se fait au moment du diagnostic ou plus tard dans le parcours du patient selon l’évolution de la maladie.
Un nouveau prélèvement de tissu tumoral, réalisé spécifiquement pour ces tests, est rarement nécessaire. Il est probable qu’un prélèvement soit déjà disponible si une biopsie a été réalisée auparavant ou si la tumeur a été opérée (ablation ou résection chirurgicale). En effet, suite à une biopsie ou à une opération, tous les prélèvements sont préservés comme une partie du dossier médical du patient.
Actuellement, le délai moyen d’obtention pour les résultats des tests moléculaires est de l’ordre de 2 à 3 semaines.
Les différentes méthodes utilisées pour identifier les anomalies moléculaires sont :
- L’immunohistochimie (IHC) qui détecte la présence et la quantité de certaines protéines cellulaires.
- L’hybridation in situ (ISH) qui permet de voir si un gène présente des anomalies, telles qu’une amplification ou une translocation.
- Le séquençage de l’ADN ou de l’ARN qui identifie les mutations ou les translocations survenues dans les gènes.
Les tests moléculaires sont effectués par des laboratoires d’anatomie et cytologie pathologiques et par des laboratoires de biologie médicale. Depuis une dizaine d’années, l’INCa a mis en place, avec le ministère chargé de la santé, une organisation spécifique au niveau national : il s’agit de 28 plateformes de génétique moléculaire réparties sur tout le territoire. Cette organisation assure une équité d’accès aux tests moléculaires pour tous les patients en France, quel que soit leur établissement de prise en charge. Ces plateformes regroupent chacune plusieurs laboratoires capables de suivre les évolutions technologiques pour être en mesure d’effectuer tous les tests nécessaires, quelle que soit la technologie devant être utilisée.
En 2014, au sein des plateformes, 70 500 patients ont ainsi bénéficié d'un test moléculaire déterminant l'accès à une thérapie ciblée disposant d'une autorisation de mise sur le marché (AMM), notamment :
- 24 000 patients avec un cancer du poumon pour une recherche de mutation d’EGFR
- 22 000 patients avec un cancer colorectal pour un test KRAS
- 9 000 patientes avec un cancer du sein pour un test HER2
Quelle est la place des tests moléculaires dans le parcours de soins et le choix du traitement ?
Actuellement, les tests moléculaires sont principalement réalisés pour les patients présentant un cancer avancé ou métastatique. Et cela, car les traitements associés à un biomarqueur ne sont autorisés que pour ces patients. Ils sont demandés quand le médecin envisage la prescription d’un traitement conditionné par la présence d’un biomarqueur ou l’inclusion dans un essai clinique.
En fonction des résultats des tests moléculaires, différents traitements peuvent être proposés :
- Si un biomarqueur est identifié dans la tumeur, la thérapie ciblée associée à celui-ci sera proposée au patient. Si une anomalie est détectée mais qu’il n’y a pas de traitement autorisé associé, un essai clinique avec une thérapie ciblant cette anomalie pourra être proposé au patient.
- Si aucun biomarqueur donnant accès à un traitement n’est identifié, un traitement approprié à la pathologie et son stade sera proposé. Il pourra s’agir d’une thérapie ciblée pour laquelle il n’existe pas de biomarqueurs, d’un traitement d’immunothérapie spécifique ou encore d’une chimiothérapie conventionnelle. Un essai clinique testant un nouveau traitement pourra également être proposé selon les cas.
Dans le cas où le traitement ne serait pas efficace, dès sa mise en place ou suite à l’apparition de résistances, un nouveau test moléculaire pourra être réalisé. En effet, certains traitements sont maintenant disponibles en cas de résistances particulières (notamment dans les cancers du poumon présentant une mutation de résistance aux traitements anti-EGFR). Une recherche d’anomalie est donc nécessaire pour mettre en évidence le mécanisme responsable de la résistance au traitement.
Il commence maintenant à être possible de suivre l’évolution de la maladie à l’aide d’un simple prélèvement sanguin. On parle de « biopsie liquide ». On recherche alors la présence d’anomalies dans l’ADN tumoral circulant (L’ADN circulant provient de la dégradation des cellules, normales ou tumorales. Une partie de l’ADN des cellules dégradées se retrouve dans la circulation sanguine et peut être analysé grâce à de nouvelles techniques très sensibles).